
Research 张鹏飞/张宏博/严飞教授团队成功构建动脉粥样硬化易损斑块靶向药物输送载体


独家抢先看
动脉粥样硬化斑块破裂后血栓形成是急性心脑血管事件的主要原因,这些易破裂斑块被称为易损斑块,通常由巨噬细胞浸润为标志的活动性炎症引起,其特点是脂质核心大、纤维帽薄。动脉粥样硬化斑块发生于动脉内膜,病变相对体积小,加之所处病变环境的血流速度快、剪切力大,这些特征阻碍了常规药物载体附着在动脉内皮细胞和高效富集于斑块内。微泡(Microbubbles)作为一种多功能载体,不仅可以载药,而且在超声下具有对比增强的特点,同时,利用超声靶向微泡破坏效应(UTMD),可使药物输送到斑块区域。然而,单一靶点的微泡并不能将药物高效精确的输送至易损斑块。
中性粒细胞是外周血白细胞中最大的群体,其在致动脉粥样硬化因素及炎症因子的趋化下能够进入到受损的内皮细胞,并与易损斑块内的巨噬细胞共定位。凋亡的中性粒细胞被巨噬细胞吞噬,这种快速的吞噬作用使巨噬细胞极化为抗粥样硬化表型以维持内稳态。研究发现,中性粒细胞能响应炎性趋化,在高剪切力环境下,通过细胞扁平化、粘附、滚动的方式与炎症区域内皮细胞相结合,有望成为一种以细胞为基础的易损斑块靶向药物输送载体。
2022年6月3日,山东大学齐鲁医院教育部和国家卫健委心血管重构与功能研究重点实验室张鹏飞教授、芬兰Åbo Akademi大学生物科学中心张宏博教授和中国科学院深圳先进技术研究院严飞研究员团队在Research(最新影响因子11.036)上发表题为“Bionic Microbubble Neutrophil Composite for Inflammation-responsive Atherosclerotic Vulnerable Plaque Pluripotent Intervention”的论文,研发出一种新型易损斑块靶向干预载体。

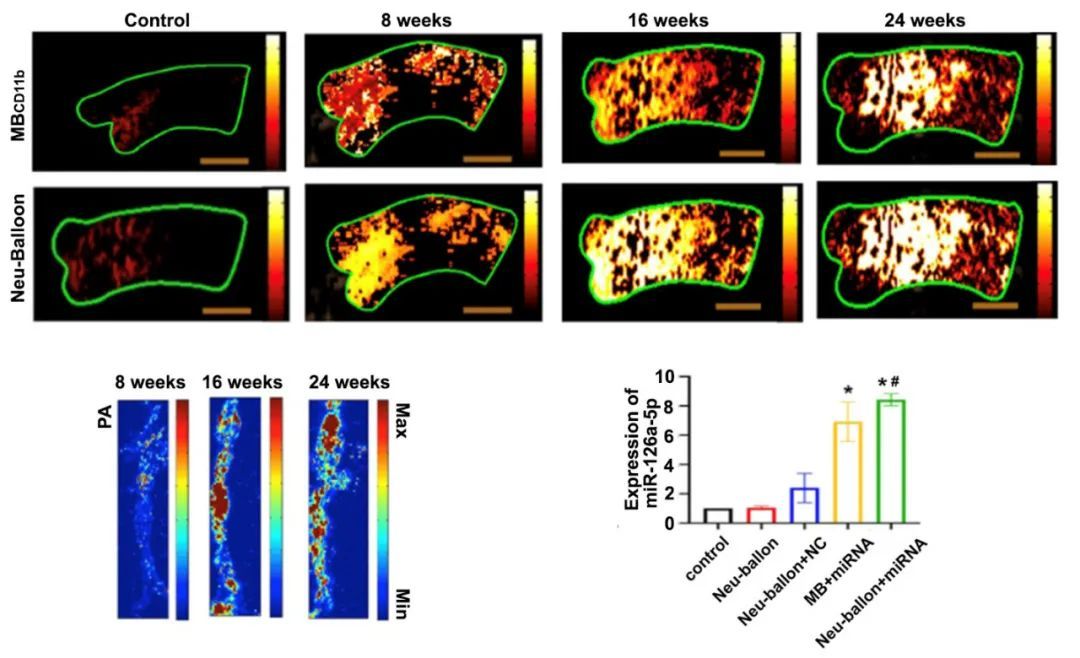
在该工作中,为了对动脉粥样硬化易损斑块进行靶向干预,研究人员构建了中性粒细胞-微泡复合体,即Neu-balloon。该复合体由微泡与中性粒细胞连接而成,使这两种药物输送载体的作用相互加强。在靶向方面,在超声场的作用下,微泡可拖动中性粒细胞离开高速轴流到外周层流,促进中性粒细胞与动脉壁的相互作用。然后中性粒细胞以仿生的方式携带荷载物进入炎性状态的内皮细胞下。超声场和超声靶向微泡破坏(UTMD)效应不影响中性粒细胞活性。为了验证Neu-balloon在高剪切力环境下的炎症趋化作用,本研究首先应用TNF-α+oxLDL刺激小鼠主动脉内皮细胞,建立模拟炎症和高胆固醇致动脉粥样硬化环境的炎症细胞模型,结果显示Neu-balloon对炎症细胞有较强的趋化粘附能力。此外,在静态或高剪切力的环境下,Neu-balloon对炎症刺激内皮细胞的粘附能力明显高于对照组。中性粒细胞分离自ApoE-/-小鼠外周血细胞,在高胆固醇和炎症反应的刺激下,这些中性粒细胞将定位并转运至斑块中,发挥对抗内皮损伤的作用。Neu-balloon通过微泡的声增强,可以应用超声进行追踪观察,同时通过UTMD效应使其荷载的靶向药物进入到斑块内。体内实验中,高脂喂养ApoE-/-小鼠8周、16周、24周,将Neu-balloon尾静脉注入小鼠体内,结果显示,斑块易损指数与小鼠主动脉弓声学强度呈正相关,表明在主动脉内高剪切力环境下,Neu-balloon可随炎症反应的发生而富集。
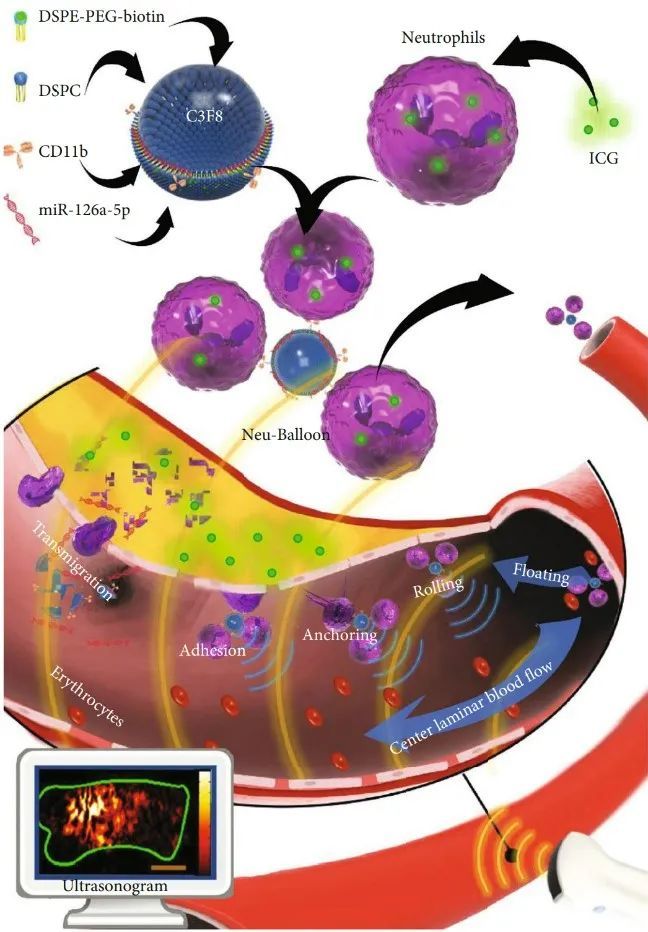
除了生物粘附和超声追踪,Neu-balloon更重要的作用是靶向输送药物至斑块中。易损斑块的治疗通常涉及生物分子的输送,如寡核苷酸、蛋白质等,中性粒细胞具有较大的载药容积,而这些生物大分子却几乎不可能与中性粒细胞一起传递,因为它们会被酶水解,而且还会引起其他副作用,如中性粒细胞自身脱粒。此外,纯细胞系统作为药物传递系统,具有载药程度低、实验重复性差、不同批次药物释放特征不一致等特点,因此,生物大分子可负载于微泡表面。对于生物小分子可通过内吞作用进入中性粒细胞,并且抵抗中性粒细胞的裂解和酸性。本研究以ICG为例,经验证,转运至斑块内ICG药物浓度与中性粒细胞加载荧光强度呈正相关,最大加载容量为2.9μg/105。MiR-126a-5p参与免疫细胞分化、血管紧张素II拮抗和脂质代谢,有稳定动脉粥样硬化斑块的作用。而miRNAs是生物大分子,因此,本研究将MiR-126a-5p负载于微泡表面。采用UTMD效应将其转运至斑块内,荧光成像和RT-PCR检测MiR-126a-5p转运至斑块的情况。MiR-126a-5p在注射后48小时斑块内检测到其高表达,而MCP-1、IL-6及ICAM-1等炎症因子的表达降低,表明MiR-126a-5p可通过Neu-balloon靶向转运至斑块中并发挥抗炎作用。UTMD可以增强加载到微泡上的miRNAs传递以及Neu-balloon的中性粒细胞部分外渗到斑块中,转运效率明显高于传统抗体偶联微泡。在观察易损斑块的追踪方面,易损斑块的识别和给药的跟踪是通过微泡的声学特点,或观察加载至Neu-balloon中性粒细胞的荧光或光声学的荧光来完成。Neu-balloon的构建成功不仅可应用于易损斑块的无创追踪,更实现了拮抗高剪切力环境下斑块的靶向给药,是一个极具前景的基因治疗载体。
本文的共同第一作者为山东大学齐鲁医院心内科刘芳芳主治医师和重症医学科毛洋医师,山东大学齐鲁医院心内科张鹏飞教授、芬兰 Åbo Akademi大学生物科学中心张宏博教授和中国科学院深圳先进技术研究院严飞研究员为本文的共同通讯作者。该工作得到了国家自然科学基金(82071939, 82030051, 12074402, 81571689)和深圳市基础研究计划(JCYJ20200109114825064)的支持。






